您即將進入之新聞內容 需滿18歲 方可瀏覽。
抗中風藥物研究數據 「刺胳針」示警
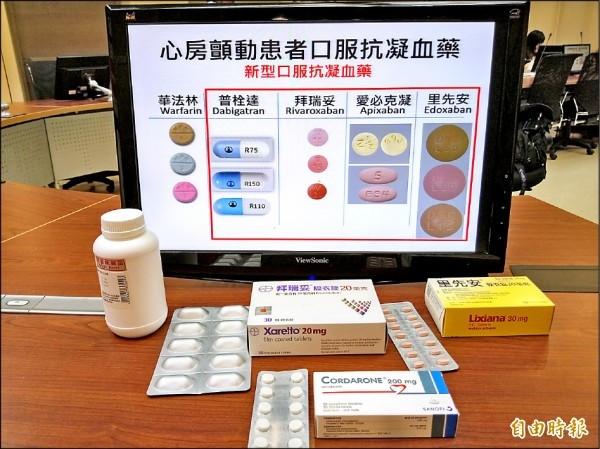
〔編譯陳成良、健康網/綜合報導〕新一代口服抗凝血劑「利伐沙班」(Rivaroxaban) 經過許多全球大型臨床試驗的考驗,已被多國國家核准上市,主要應用在預防靜脈血栓栓塞和心房顫動患者中風,未來在動脈血栓、急性冠心病的治療上也深具潛力。不過英國權威醫學期刊《刺胳針》(The Lancet)質疑,「利伐沙班」多年前的臨床實驗數據不準確,認為該藥有致命副作用的隱憂。
德國製藥巨頭拜耳(Bayer)研發的「利伐沙班」,以「拜瑞妥」(Xarelto)等品牌銷售,據估計單單2019年一年,全球銷售額已接近54億英鎊(約台幣2000億元)。
《刺胳針》2009年曾發表一項名為「Record4」的研究報告,為「利伐沙班」安全性背書,並評估該藥能有效預防手術後血栓。據英國《每日郵報》7日報導,「Record4」研究的部分資金,正是來自開發該藥物的拜耳公司。
報導中稱,美國食品藥物管理局(FDA)同年曾否決這項研究,指研究當中使用的數據不可靠。後來,不同研究小組進行3項後續研究,2年後,英美兩國批准「利伐沙班」用於預防中風。
去年12月,《刺胳針》的競爭對手《英國醫學期刊》(BMJ)提供了來自FDA 報告的證據,指前述研究涉存在不準確,或誤導患者使他們忽略服藥後可能出現副作用,當中包括嚴重甚至可能會致命的出血風險。
FDA 報告的證據,指參與「利伐沙班」實驗的16家醫院中,有8家的結果存在大量嚴重數據缺陷。有兩間醫院更瞞報嚴重副作用,有4名服用「利伐沙班」的患者在為3週試驗期間死亡,但研究人員未能對此作出解釋。其中一名患者的情況更列為死因不明。
《每日郵報》指出,迫於壓力,《刺胳針》發出前述警告,並將展開相關調查。
對此,「Record4」報告的主要作者、加拿大麥克馬斯特大學(McMaster University)名譽醫學教授特皮(Alexander Turpie)回應稱,FDA並非決定數據可靠性的仲裁者。據他解釋,大量對照研究提交醫學期刊後,因可靠性而遭拒絕,但重新提交至其他地方仍能發表。
特皮認為,「Record4」研究數據屬於上述情況,雖然FDA認為數據不可靠,但有關主要功效和安全性結論仍然合理。
台灣拜耳:拜瑞妥安全無虞
台灣拜耳企業表示, FDA並沒有改變對拜瑞妥(Xarelto)有力的風險評估,拜瑞妥在所有核准適應症都建立有效的安全性和療效,並且有多項臨床研究持續證實正向的治療效益和風險評估。文章原文僅是針對RECORD 4 這個臨床試驗的數據提出疑問,以及The Lancet這個期刊為何會通過且發表有數據疑慮的臨床試驗,而並非直接挑戰此藥品的療效以及安全性。
拜耳向各大醫療院所及醫療人員發函說明,包括:RECORD 4 臨床試驗研究並未成為拜瑞妥(Xarelto)任何適應症基準的基礎;FDA對RECORD 4 臨床試驗的審查自2011年以來都公開於網站中,並且沒有改變對拜瑞妥(Xarelto)有力的風險評估;RECORD 4為有關膝關節置換術的研究,並未涉及心房顫動患者的中風預防(SPAF)或靜脈血栓栓塞症(VTE)的治療等等。
發燒新聞












網友回應