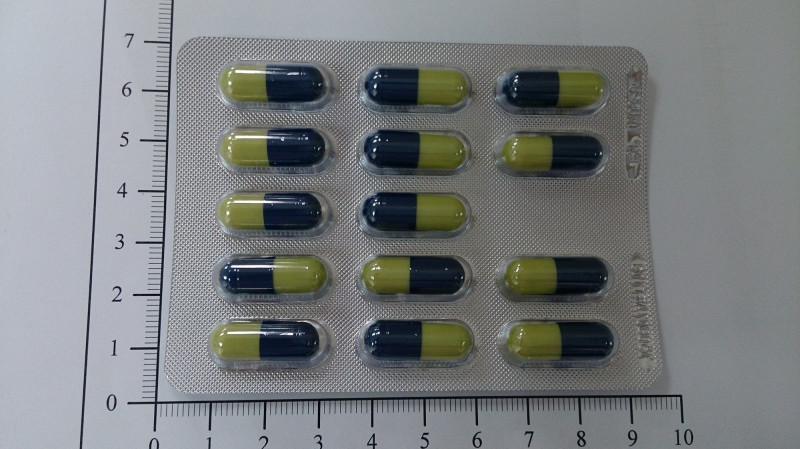
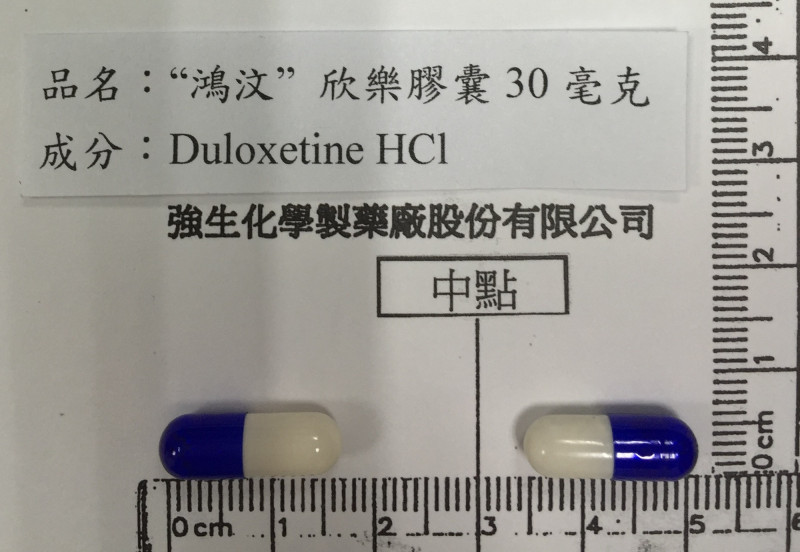
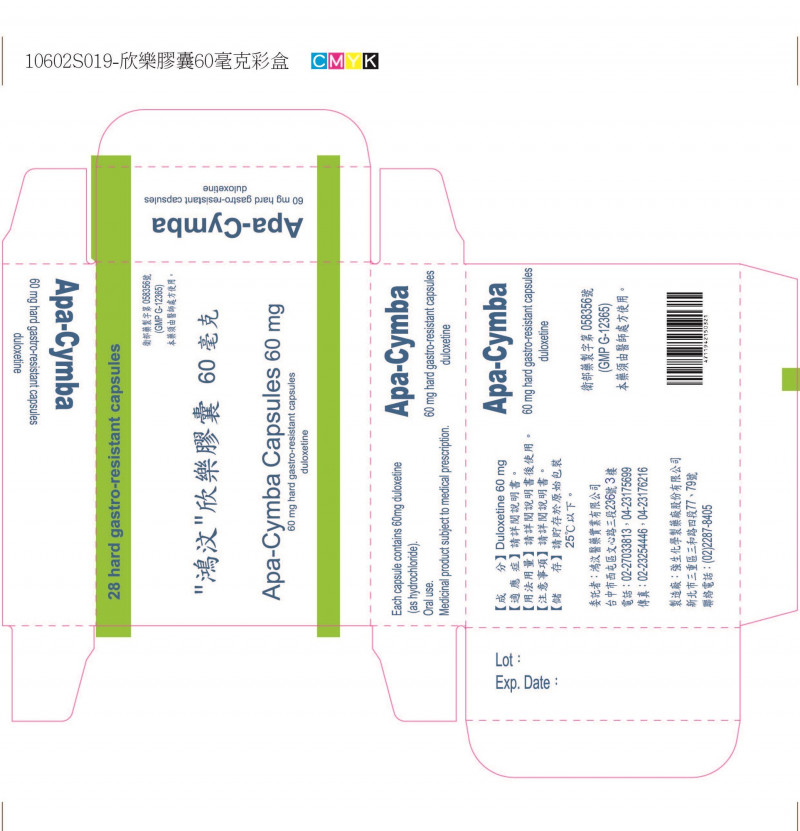
〔記者吳亮儀/台北報導〕食品藥物管理署今天公布藥品回收警訊,「鴻汶欣樂膠囊60毫克(Apa-Cymba Capsules 60mg)」和30毫克產品因廠商主動通報溶離試驗果不符規格,除了得回收市面上藥物外,藥廠全面停產並重新研發。
由鴻汶醫藥公司生產的「欣樂膠囊」主成分為duloxetine hydrochloride,主要用於重鬱症、廣泛性焦慮症、糖尿病周邊神經痛、纖維肌痛。
食藥署副署長陳惠芳指出, 這兩款鴻汶欣樂膠囊是同成分但不同含量的產品,該款藥品屬於延遲控釋膠囊,原本效期為2年,業者是在進行第12個月的安定性試驗時,發現溶離試驗結果未符合規格,在模擬胃的酸性環境下溶離度未達標準,恐影響人體的吸收效率,所以業者決定全面啟動回收。
劑量30毫克的共18批需回收、60毫克的共39批需回收,共計57批、約69.3萬顆藥。根據健保年度用量統計,這兩款藥在2021年用量分別達18.7萬顆、26.5萬顆,兩者市佔率各為0.68%和16.74%,應不至於影響病患用藥。
食藥署要求廠商要在下月16日前完成回收作業,並繳交回收成果報告書及後續預防矯正措施。並請各醫療院所、藥商、藥局配合辦理回收作業,立即停止調劑、供應。