〔記者林曉雲/台北報導〕國立中央大學生醫系特聘教授李宇翔和副教授許藝瓊,攜手台北榮總內科部胃腸肝膽科醫師黃惠君與許紹榮,以及國立陽明交通大學生醫系教授李泉團隊,成功建立安全有效的肝纖維化動物模型,有助於慢性肝病防治與研究,研究成果刊登在「Biomaterials Science」國際期刊。
李宇翔說明,肝臟疾病常面臨「肝纖維化、肝硬化、肝癌」三部曲,「肝纖維化」是肝臟受損傷後細胞外基質合成、降解與沈積不平衡的一種修復反應,亦是眾多肝病的起始源頭,對肝纖維化進行早期診斷、治療以預防後續病況惡化的發生,對肝病防治具有重要意義。
現階段建立動物肝纖維化模型,最常用的方法是使用毒物化學法和手術方法,但毒物化學法耗時、具潛在致癌性,手術也具侵入性,變異性和死亡率高,導致實驗鼠非常虛弱,難以進行後續的新藥測試或其他長期實驗。
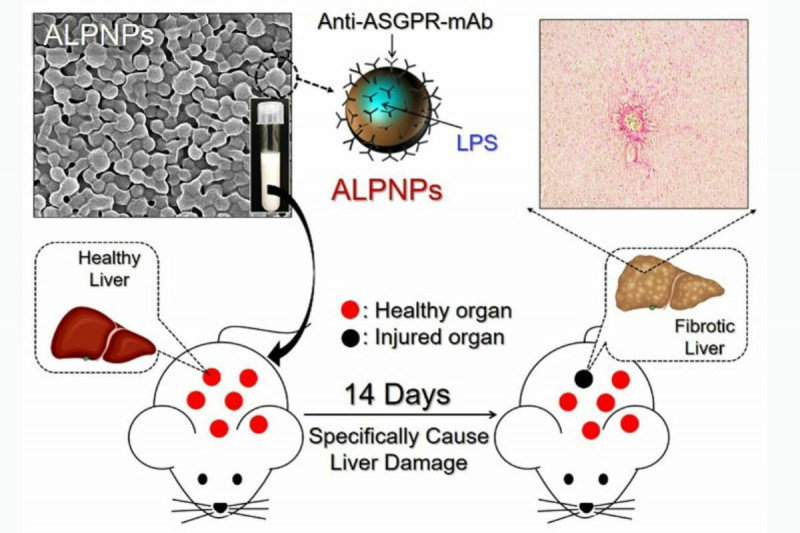
研究團隊透過新一代奈米載體技術,可以精準地將藥物傳遞至動物肝臟,不影響其他內臟,如心、肺、脾和腎等器官健康,使後續新藥測試更有效率。李宇翔表示,關鍵技術在於研究團隊設計一種奈米粒子藥物載體(ALPNP),搭載能夠造成肝纖維化的藥物,並具有精準直接到肝臟的能力,直接注射藥物經血管到達全身各地,會造成多處器官損傷,但ALPNP的表面修飾建構的去唾液酸糖蛋白受體 (ASGPR)分子,可使ALPNP與肝臟細胞做專一性結合,使大部分藥物只在肝臟釋放造成肝臟損傷,而保持其他器官健康。
該技術優點是生物相容性,載體使用的材料是高分子PLGA,能被人體生物體接受,少有副作用或不適感,已廣泛應用,另ALPNP能精準地將藥物傳送到肝臟,所需有效藥物劑量可大幅減少,進而降低實驗動物受到全身毒性損傷,將提供給藥廠、生技公司或醫療研究單位,以加速新藥研發測試。
免費訂閱 《自由體育》電子報 熱門賽事、球星動態不漏接